Модель идеального газа, изопроцессы
Лекция № 8 Модель идеального газа. Изопроцессы.
Строение газообразных, жидких и твердых тел
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях.
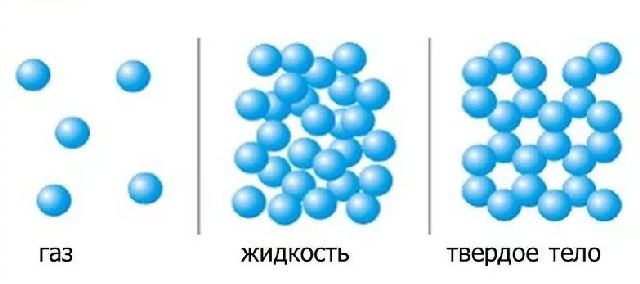
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул (рис.1). Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но форма молекулы не изменяется (рис.2).
Рис.1 Рис.2
Молекулы с огромными скоростями — сотни метров в секунду – движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу (рис.3), поэтому молекула жидкости ведет себя иначе, чем молекула газа.
В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения равновесия, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т. е. суммарная сила взаимодействия молекулы равна нулю.
Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12 -10-13 с). С повышением температуры время оседлой жизни молекул уменьшается.
Рис.3
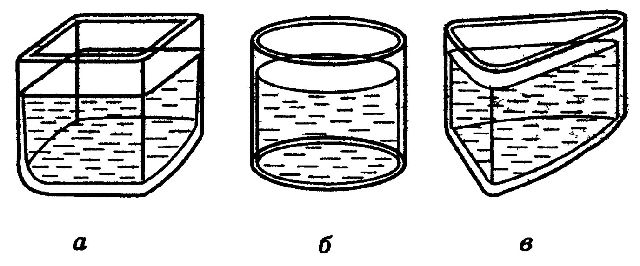
Рис.4
Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И.Френкелем, позволяет понять основные свойства жидкостей.
Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема, силы отталкивания становятся, очень велики. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.4). Вот почему жидкость течет и принимает форму сосуда.
Твердые тела. Атомы или молекулы твердых тел, в отличие от атомов и молекул жидкостей, колеблются около определенных положений равновесия. По этой причине твердые тела сохраняют не только объем, но и форму. Потенциальная энергия взаимодействия молекул твердого тела существенно больше их кинетической энергии.
Есть еще одно важное различие между жидкостями и твердыми телами. Жидкость можно сравнить с толпой людей, где отдельные индивидуумы беспокойно толкутся на месте, а твердое тело подобно стройной когорте тех же индивидуумов, которые хотя и не стоят по стойке смирно, но выдерживают между собой в среднем определенные расстояния. Если соединить центры положений равновесия атомов или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической.
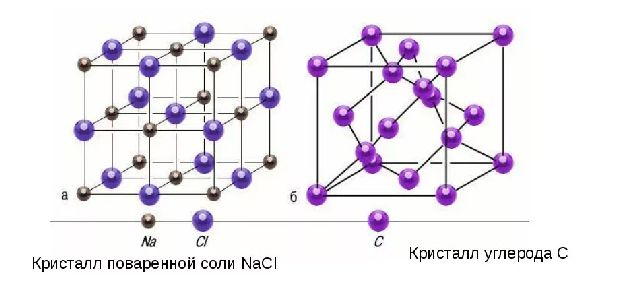
На рисунках 5 и 6 изображены кристаллические решетки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Рис.5 Рис.6
У газа расстояние l между молекулами много больше размеров молекул r0:l>>r0.
У жидкостей и твердых тел l≈r0. Молекулы жидкости расположены в беспорядке и время от времени перескакивают из одного оседлого положения в другое.
У кристаллических твердых тел молекулы (или атомы) расположены строго упорядоченно.
Кристаллизация — процесс фазового перехода вещества из жидкого состояния в твёрдое состояние.
Модель идеального газа
Наиболее простой теоретической моделью газа является идеальный газ. В этой модели пренебрегают размерами и взаимодействиями молекул и учитывают лишь их упругие столкновения. Более реальной является расширенная модель идеального газа, в которой молекулы представляются упругими сферами с конечным диаметром d, а взаимодействие по-прежнему учитывается только при непосредственном упругом столкновении молекул.
Установим критерий, следуя которому можно установить, когда газ можно рассматривать как идеальный. Ясно, что газ будет идеальным, если расстояние r между его молекулами такое, что силой взаимодействия между ними на этом расстоянии можно пренебречь. Как мы знаем, силы взаимодействия между молекулами быстро убывают с расстоянием r и уже на расстояниях в несколько диаметров d молекулы пренебрежимо малы. Поэтому условие идеальности газа в расширенном понимании можно записать в виде:
r>>d (1)
Расстояние r нетрудно выразить через такой важный параметр газа как концентрацию n=N/V, здесь N – число частиц в газе, а V – его объем. В самом деле, если газ находится в равновесии, при отсутствии внешних полей его молекулы будут равномерно распределены в объеме V м3 , и тогда на ребре куба длиной 1 м расположиться 3√n молекул. Следовательно, среднее расстояние между молекулами составит
r = 1/3√n (2)
Из соотношений (1) и (2) следует, что критерий идеальности газа можно представить следующим образом
nd 3<< 1 , nd 3 – безразмерный параметр (3)
Учитывая, что число частиц в газе N=mNA /m , концентрацию можно выразить через плотность ρ газа:
n = N/ѵ = (m/ν)*(Na/m) = ρNa/m (4)
где ρ = m/V — плотность газа
Выражение (4) позволяет записать критерий идеальности газа (5) в эквивалентной форме
ρNAd3/m<<1 (5),
где: ρ – плотность газа; Na – постоянная Авагадро; m – масса газа; ν = N/Na – количество вещества.
Изопроцессы
Изопроцессы — это процессы, протекающие при неизменном значении одного из макроскопических параметров (р, V, Т).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
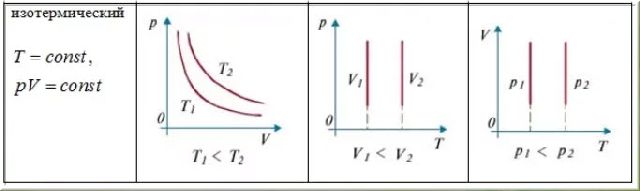
Изотермический процесс описывает закон Бойля- Мариотта, открытый в 1861 г. английским ученым Р. Бой-лем (1627-1691) и в 1876 г. французским ученым Э. Мари-оттом (1620-1684). При постоянной массе газа pV = const.
Для газа данной массы произведение давления на его объем постоянно, если температура не меняется.
Графики изотермического процесса в координатах р-V; р-Т; V-Т имеют следующий вид (рис. 7):
Рис.7
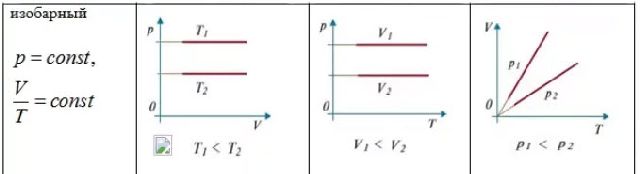
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным. Из уравнения Менделеева-Клапейрона следует, что при
постоянной массе газа
Рис.8
Для данной массы газа отношение объема к температуре постоянно, если давление газа не меняется.
Этот закон был установлен экспериментально в 1802 г. французским ученым Ж. Гей-Люссаком (1778-1850).
Графики изобарического процесса в координатах р-V; V-Т; р-Т имеют следующий вид (рис. 8):
Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным. Из уравнения Менделеева-Клапейрона можно записать:
Для данной массы газа отношение давления к температуре постоянно, если его объем не меняется. Графики изохорного процесса в координатах р-V; V-Т; р-Т имеют следующий вид (см. рис. 9). Этот закон был установлен экспериментально в 1787 г. Ж. Шарлем (1746-1823).



![Синдикация через RSS [x]](http://razmishlyajem.ru/wp-content/themes/mad-meg/images/rss.png)